UNIST, 암세포의 복제 스트레스 관리자 없애자 대장암 증식이 멈췄다
암세포가 DNA 복제 과정에서 스스로 붕괴하지 않도록 조절해 온 ‘복제 스트레스 관리자’를 제거해, 암세포 증식을 근본적으로 멈추는 메커니즘을 규명했다.
UNIST는 5일, 생명과학과 채영찬 교수팀이 신경 단백질로만 알려졌던 NSMF가 대장암 세포의 DNA 복제 스트레스를 관리하며 암의 성장을 돕는 역할을 한다는 사실을 밝혀내고, 이 단백질을 억제해 암세포를 영구적인 노화 상태로 유도했다고 전했다. NSMF를 차단하자 암세포는 감당할 수 없는 수준의 복제 스트레스를 받아 분열을 멈췄으며, 정상 세포에는 거의 영향을 주지 않았다. 이는 암세포만 정밀하게 겨냥하는 차세대 표적 항암 전략의 가능성을 보여준다.
암세포는 왜 ‘복제 스트레스 관리자’를 필요로 할까
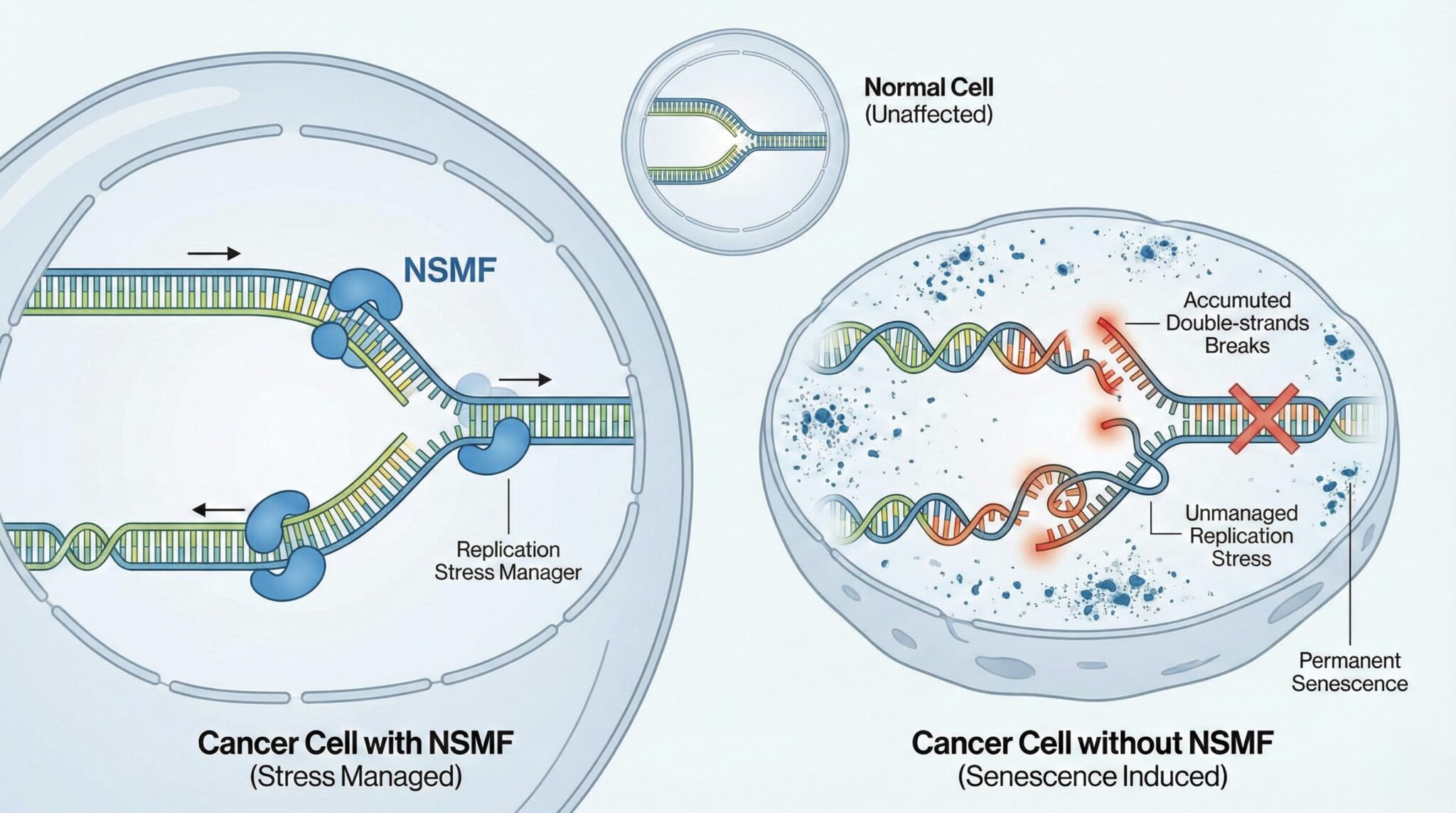
암세포의 가장 큰 특징은 통제되지 않은 증식이다. 이 과정에서 DNA를 복제하는 속도가 이를 따라가지 못하면 ‘DNA 복제 스트레스’가 발생한다. 복제 스트레스란 DNA가 복제 도중 멈추거나 엉키는 현상으로, 일정 수준을 넘어서면 DNA 이중 가닥이 끊어지고 세포는 더 이상 분열하지 못한 채 노화 상태에 빠진다.
UNIST 연구진은 대장암 세포가 이 위기를 피하기 위해 NSMF라는 단백질을 활용하고 있음을 밝혀냈다. NSMF는 원래 신경세포 이동과 발달에 관여하는 단백질로 알려져 있었지만, 이번 연구를 통해 암세포에서는 복제 스트레스를 ‘임계값 이하’로 조절하는 관리자 역할을 수행한다는 사실이 처음 확인됐다.
연구팀이 환자 유전체 데이터를 분석한 결과, 암세포의 복제 스트레스가 높을수록 NSMF 발현량도 함께 증가했다. 이는 암세포가 불안정한 유전체 상태를 유지하면서도 스스로 파괴되지 않도록 NSMF에 의존하고 있음을 의미한다. 다시 말해, NSMF는 암세포가 위험한 줄타기를 계속할 수 있게 해주는 안전장치였다.
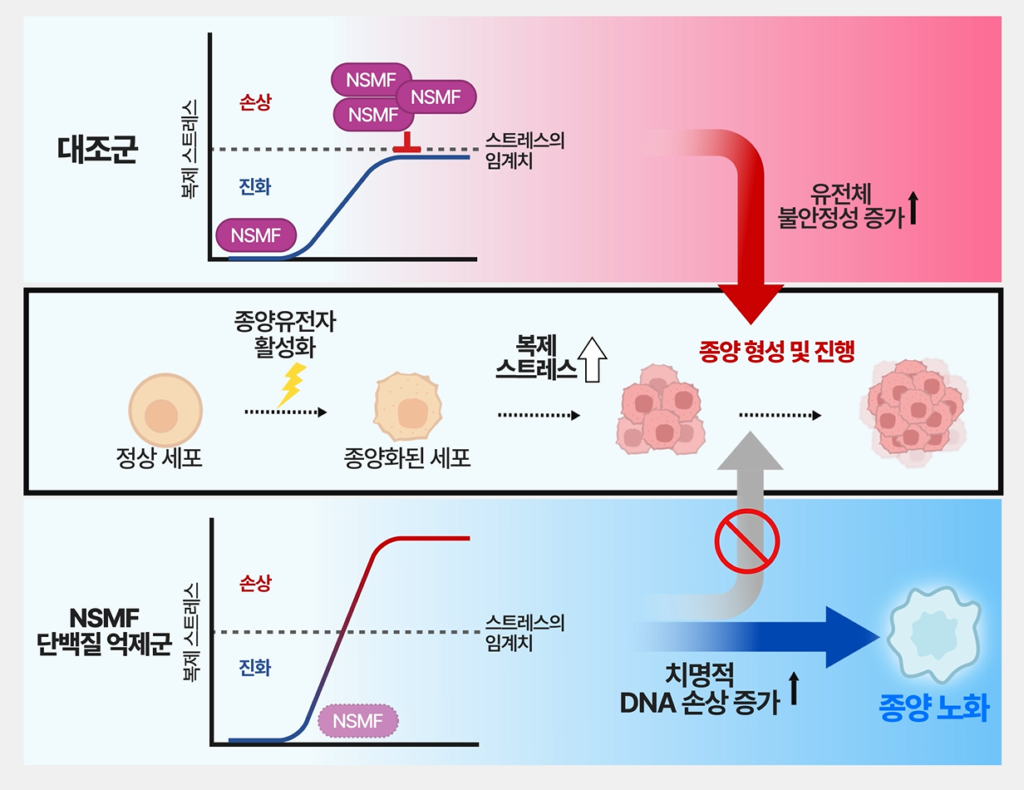
암세포의 복제 스트레스 관리자 NSMF는 암세포 증식과정에 복제 스트레스를 ‘임계값(Threshold of excessive stress)’ 이내로 유지하도록 조절함으로써 암세포가 치명적인 DNA 손상과 노화를 피하면서도 성장에 유리한 유전적 불안정성을 확보할 수 있게 돕는다.
암세포만 늙게 만드는 새로운 항암 전략
연구진이 NSMF의 발현을 억제하자, 대장암 세포에서는 즉각적인 변화가 나타났다. DNA 복제가 진행되는 지점인 ‘복제 포크’의 이동 속도가 급격히 느려졌고, DNA 이중 가닥이 끊어지는 치명적인 손상이 축적됐다. 그 결과 암세포는 더 이상 분열하지 못하고 영구적인 세포 노화 상태에 들어갔다.
주목할 점은 정상 세포에는 거의 부작용이 없었다는 사실이다. 정상 세포는 애초에 복제 스트레스 수준이 낮아 NSMF 없이도 DNA 복제를 감당할 수 있기 때문이다. 이는 기존 항암 치료의 가장 큰 문제였던 정상 세포 손상을 최소화할 수 있음을 시사한다.
동물 실험에서도 효과는 분명했다. 대장암에 취약한 생쥐 모델에서 NSMF 발현을 억제하자 암 발생 빈도가 줄었고, 암이 생기더라도 성장이 억제돼 생존 기간이 33.5% 늘어났다. 연구 결과는 국제 학술지 <Nucleic Acids Research>에 게재됐다.
채영찬 교수는 “뇌 신경 단백질로만 알려졌던 NSMF가 암세포의 생존을 떠받치는 핵심 인자라는 점을 밝혀냈다”며 “NSMF 저해제는 암세포가 스스로 늙어 멈추게 만드는 전혀 새로운 항암 전략이 될 수 있다”고 설명했다.
암을 직접 공격하는 대신, 암이 버텨온 내부 질서를 무너뜨리는 접근이다. 이번 연구는 정밀 항암 치료가 향할 다음 방향을 명확히 보여준다.