예일대, 파킨슨병 확산시키는 단백질 규명
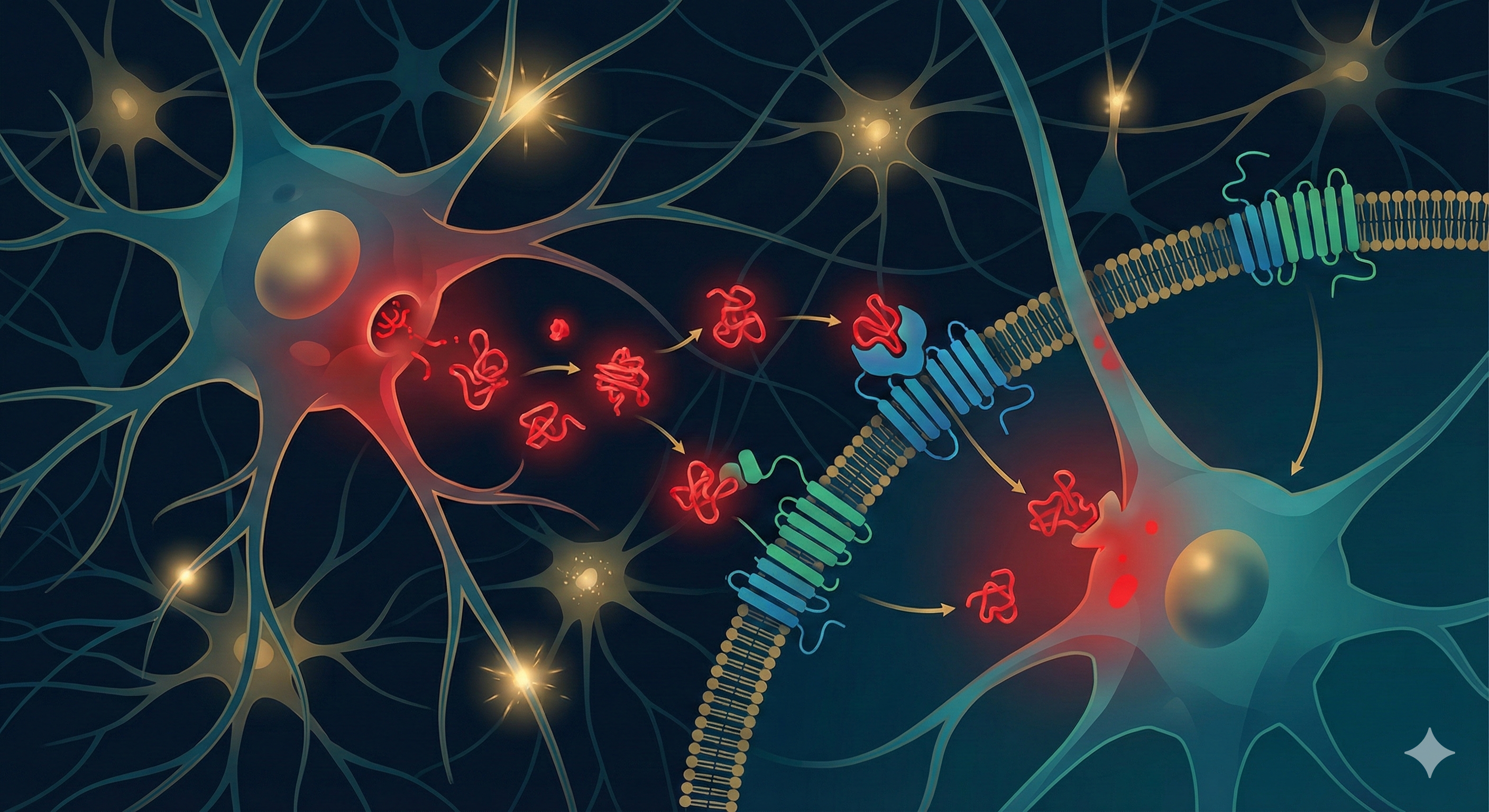
파킨슨병이 뇌에서 퍼지는 메커니즘이 규명됐다. 예일대 의대(YSM) 신경과학과 스티븐 스트리트매터(Stephen Strittmatter) 교수팀은 지난 6일, 뇌 운동신경세포 표면에 있는 mGluR4와 NPDC1이라는 두 막단백질이 잘못 접힌 α-시누클레인(파킨슨병을 일으키는 단백질)을 건강한 신경세포 안으로 운반한다는 사실을 밝혔다고 발표했다.
막단백질은 세포 표면에 박혀 있는 단백질로, 세포 안팎의 물질 이동을 담당한다. 파킨슨병은 α-시누클레인이 잘못 접혀 신경세포에 쌓이면서 세포를 죽이는 질환이다. 이 잘못 접힌 단백질이 죽어가는 세포에서 빠져나와 신경세포 간에 퍼지지만, 그 메커니즘은 알려지지 않았다. 연구팀은 4,400개의 서로 다른 세포 표면 단백질을 발현하는 세포를 만들어 실험한 결과, 16개만이 α-시누클레인과 결합했고, 그중 파킨슨병이 발생하는 뇌 부위인 흑질의 도파민 신경세포에서 발견되는 mGluR4와 NPDC1이 실제로 단백질을 세포 안으로 운반한다는 것을 확인했다. 연구 결과는 국제 학술지 <Nature Communications> 2025년판에 게재됐다.
세포 표면 단백질이 병을 퍼뜨린다
파킨슨병은 미국에서 약 110만 명이 앓고 있으며, 매년 9만 명의 신규 환자가 발생한다. 환자들은 떨림, 균형 장애, 느린 동작 등 운동 장애를 겪는다. 이런 증상은 뇌의 흑질(substantia nigra, 운동 조절에 관여하는 뇌 부위)에 있는 도파민 신경세포(도파민이라는 신경전달물질을 만드는 세포)에 잘못 접힌 α-시누클레인이 쌓이면서 세포가 죽기 때문에 나타난다.
α-시누클레인이 잘못 접혀 축적되면 신경세포가 서서히 파괴된다. 더 큰 문제는 이 잘못 접힌 단백질이 신경세포 사이를 퍼진다는 점이다. 증상이 악화되는 것은 α-시누클레인이 신경세포 간에 확산되기 때문이다. 하지만 어떻게 한 세포에서 다른 세포로 이동하는지는 미스터리였다.
스트리트매터 교수는 “잘못 접힌 α-시누클레인은 파킨슨병의 병리학적 특징”이라며 “이것이 어떻게 신경세포 안으로 들어가는지 이해하면, 병의 진행을 막거나 늦출 수 있다”고 말했다. 하지만 그러려면 “분자 수준에서 어떻게 퍼지는지 메커니즘을 이해해야 한다”고 덧붙였다.
연구팀은 α-시누클레인이 세포 표면 단백질에 결합해 세포 안으로 들어간다는 가설을 세웠다. 이를 확인하기 위해 각각 다른 세포 표면 단백질을 발현하는 4,400개 세포 집단을 만들고, 잘못 접힌 α-시누클레인이 어디에 결합하는지 관찰했다.
대부분의 세포 표면 단백질은 α-시누클레인과 결합하지 않았다. 하지만 16개는 결합했다. 그중 흑질의 인간 도파민 신경세포에서 발견되는 mGluR4와 NPDC1이라는 두 단백질이 실제로 잘못 접힌 α-시누클레인을 세포 안으로 운반한다는 것을 연구팀은 확인했다.
이 결과를 보고 연구팀은 두 세포 표면 단백질이 α-시누클레인을 신경세포 간에 이동시키는 데 관여할 것으로 추정했다. 이를 검증하기 위해 연구팀은 mGluR4나 NPDC1이 작동하지 않도록 유전자를 조작한 생쥐를 만들고, 잘못 접힌 α-시누클레인을 주입했다.
정상 생쥐는 잘못 접힌 α-시누클레인이 뇌에 축적되고 파킨슨병 증상이 나타났다. 하지만 mGluR4나 NPDC1이 작동하지 않는 생쥐는 증상이 나타나지 않았다. 연구팀은 또한 파킨슨병 생쥐 모델에서 이 두 세포 표면 단백질의 유전자를 제거하면 사망 위험이 줄어들고 증상 진행도 감소한다는 것을 확인했다.
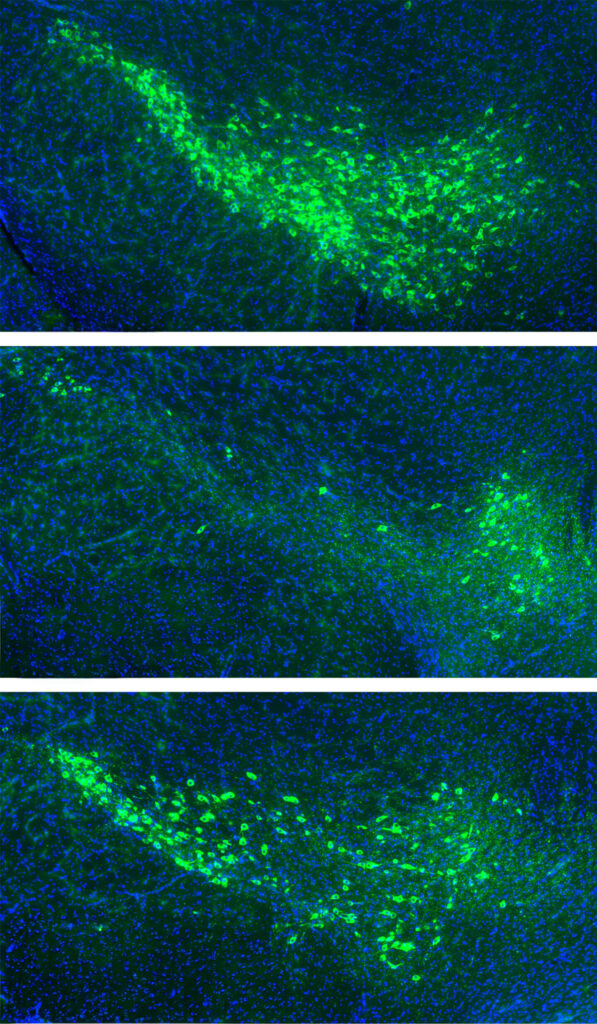
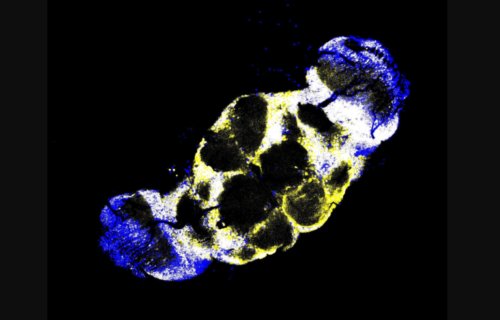
위: 정상 생쥐의 뇌에서 도파민 세포(녹색)가 건강하게 유지됨.
가운데: 잘못 접힌 파킨슨병 단백질에 노출되면 도파민 세포가 죽어 사라짐.
아래: mGluR4와 NPDC1을 제거한 생쥐는 같은 단백질에 노출돼도 도파민 세포가 살아남음.
출처: Yale School of Medicine
증상 완화가 아닌 진행 차단
이번 발견은 파킨슨병 치료에 새로운 방향을 제시한다. 스트리트매터 교수는 “이번 연구 결과는 파킨슨병 치료의 잠재적 방향을 제시한다”고 말했다. 현재 파킨슨병 치료는 증상을 완화하는 데 초점을 맞춘다. 하지만 병 자체의 진행은 효과적으로 막지 못한다.
스트리트매터 교수는 “α-시누클레인의 확산을 직접 공격하면 파킨슨병의 진행을 늦추거나 멈출 수 있는 치료법을 제공할 수 있다”고 설명했다.
이런 새로운 치료법은 앞으로 수십 년간 특히 중요해질 것이다. 파킨슨병과 다른 신경퇴행성 질환은 주로 고령층에 영향을 미친다. 미국에서 65세 이상 인구는 앞으로 수십 년간 증가할 것으로 예상된다. 이는 더 많은 사람들이 파킨슨병 위험에 처한다는 것을 의미한다.
스트리트매터 교수는 “우리는 고령화 사회를 맞이하고 있다. 신경세포가 죽는 것을 막거나 늦추는 방법은 엄청난 문제”라며 “지금이 정말 어떻게 늦출 수 있는지 진전을 만들어야 할 때”라고 강조했다.
물론 실용화까지는 넘어야 할 산이 많다. 이번 연구는 생쥐 실험이고, 사람에게도 같은 메커니즘이 작동하는지 확인해야 한다. 또한 mGluR4와 NPDC1을 표적으로 하는 약물을 개발해야 한다.
하지만 이번 연구는 파킨슨병이 어떻게 신경세포 간에 퍼지는지 분자 수준의 메커니즘을 밝혔다는 점에서, 병의 진행을 막는 새로운 치료법 개발의 기반을 제공했다.