고려대, 빛으로 세포 사멸 제어하는 퇴행성 질환 치료 기술 개발
세포의 생사를 빛으로 조절하는 기술이 개발됐다. 고려대학교 정석 교수 연구팀은 6일, 빛을 비춰 세포가 스스로 죽는 과정을 막는 데 성공했다고 밝혔다. 연구팀은 세포 사멸을 유도하는 핵심 단백질 BAX(박스)의 움직임을 빛으로 차단했다. 파란 빛에 반응하는 광유전학(빛으로 생체 조직의 세포들을 조절하는 생물학 기술) 기법을 활용해 BAX가 작동하지 못하도록 손을 묶어버린 셈이다. 이 기술은 뇌 속 신경세포가 과하게 죽어서 생기는 알츠하이머병, 파킨슨병 같은 퇴행성 질환 치료에 활용될 수 있다. 연구 성과는 국제 학술지 ‘Experimental & Molecular Medicine(IF=12.9)’ 12월 26일자에 게재됐다.
세포 죽음의 핵심 단백질, BAX 무력화
우리 몸의 세포는 스스로 죽을 수 있다. 이를 ‘세포 사멸(apoptosis, 아포토시스)’이라 부르는데, 손상되거나 늙은 세포를 제거해 몸을 건강하게 유지하는 필수 과정이다. 하지만 이 과정이 과도하게 일어나면 문제가 된다. 알츠하이머병이나 파킨슨병 같은 퇴행성 뇌질환은 뇌 속 신경세포가 필요 이상으로 죽어서 발생한다.
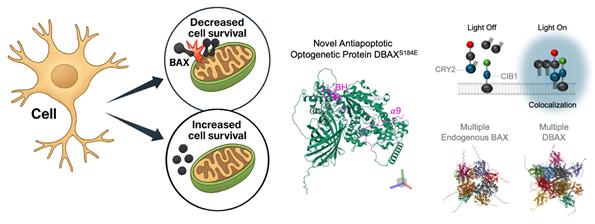
세포 사멸의 핵심은 세포의 에너지 발전소이자 죽음의 방아쇠 역할을 하는 미토콘드리아다. 평소 세포질(세포 내부 액체)에 흩어져 있던 죽음의 신호 단백질 BAX(박스)가 스트레스를 받으면 미토콘드리아로 이동한다. 미토콘드리아에 도착한 BAX는 여러 개가 뭉쳐서 미토콘드리아 외막에 구멍을 뚫는다. 이 구멍을 통해 독성 물질이 새어나와 세포를 파괴한다.
그동안 암 치료 연구는 이 구멍을 억지로 뚫어서 암세포를 죽이는 방향, 즉 세포 사멸을 ‘촉진’하는 데 집중했다. 반대로 세포 사멸을 ‘억제’하는 연구는 상대적으로 적었다. 정석 교수 연구팀은 이 간극에 주목했다.
연구팀이 사용한 방법은 빛에 반응하는 두 단백질의 결합을 이용하는 것이다. 파란 빛을 받으면 서로 달라붙는 성질을 가진 단백질 CRY2(크라이투)와 CIB1(시비원)이 핵심이다. 연구팀은 CRY2에 죽음의 신호 단백질 BAX를 연결하고, CIB1에는 미토콘드리아 외막에 박혀있는 고정 단백질 TOMM20(톰투엔티)을 붙였다.
작동 원리는 이렇다. 파란 빛을 비추면 CRY2와 CIB1이 찰싹 달라붙는다. CRY2에 매달린 BAX는 자연스럽게 미토콘드리아 표면의 TOMM20 쪽으로 끌려간다. 여기서 핵심은 BAX가 미토콘드리아에 ‘잘못된 방식’으로 도착한다는 점이다. TOMM20에 꽁꽁 묶여 있는 BAX는 여러 개가 뭉쳐 구멍을 만드는 정상 작동을 할 수 없다. 마치 양손이 뒤로 묶인 채로 범죄 현장에 도착한 범인처럼 할 일을 못하는 상태가 된다.
연구팀은 이렇게 새롭게 설계한 ‘죽음 억제’ 단백질 복합체를 DBT(deterring-BAX-TOMM20 복합체)라 명명했다. ‘deterring(디터링)’은 ‘막다, 억제하다’라는 뜻이다.
암 치료와 정반대 방향, 세포를 살리는 기술
연구팀이 DBT를 적용한 세포는 BAX가 미토콘드리아 외막에 구멍을 만드는 과정이 효과적으로 억제됐다. 미토콘드리아의 구조가 안정적으로 유지되고 세포 생존율이 크게 향상됐다. 반면 일반 단백질을 적용한 경우에는 세포 사멸이 빠르게 진행됐다.
정석 교수는 “세포 사멸은 생명 유지에 필수적인 과정이지만, 특정 질환에서는 과도하게 진행돼 문제가 된다”라며 “이번에 개발한 광유전학적 BAX 조절 기술은 불필요한 세포 사멸을 억제하는 새로운 플랫폼으로, 향후 다양한 퇴행성 질환 치료 연구에 폭넓게 활용될 수 있을 것”이라고 밝혔다.
이번 연구의 가장 큰 의미는 세포 사멸을 촉진하는 암 치료 연구와 정반대 방향을 개척했다는 점이다. 암은 세포가 안 죽고 계속 증식하는 병이라 세포를 죽이는 연구가 주류였다. 하지만 퇴행성 질환은 세포가 과하게 죽는 병이다. 연구 방향 자체가 정반대다.
특히 광유전학이라는 정밀한 도구를 사용했다는 점도 주목할 만하다. 약물로 세포 사멸을 억제하려면 온몸에 약이 퍼져 부작용이 생길 수 있다. 하지만 빛은 원하는 부위에만, 원하는 시간에만 정확하게 조사할 수 있다. 마치 레이저 포인터처럼 정밀하게 타겟팅할 수 있다는 장점이 있다.
물론 실제 환자 치료까지는 넘어야 할 산이 많다. 먼저 빛에 반응하는 단백질을 만드는 유전자(CRY2-BAX, CIB1-TOMM20)를 환자 세포에 집어넣어야 한다. 현재 유전자 치료 기술이 발전하고 있지만 효율과 안전성이 완벽하지 않다. 또 뇌 깊숙한 곳의 신경세포에 어떻게 파란 빛을 전달할지도 기술적 과제다. 광섬유를 뇌에 삽입하는 방법이 연구되고 있지만, 뇌를 직접 건드려야 하는 침습적(몸을 직접 침범하는) 시술이라는 한계가 있다.
그럼에도 이번 연구는 ‘항 사멸(anti-apoptosis)’ 기술이라는 새로운 영역을 개척했다는 점에서 의미가 크다. 세포를 살리는 기술은 퇴행성 질환뿐 아니라 뇌졸중, 심근경색 같이 세포가 갑자기 대량으로 죽는 급성 질환에도 적용될 수 있다.
빛으로 세포의 죽음을 조절한다는 발상은 공상과학 같지만, 실험실에서는 이미 작동하고 있다. 실제 환자에게 적용되기까지는 시간이 걸리겠지만, 적어도 우리는 세포 사멸이라는 생명의 근본 과정을 더 정밀하게 이해하고 조절할 수 있는 새로운 도구를 갖게 됐다.