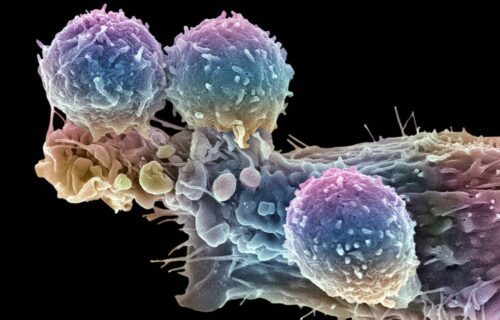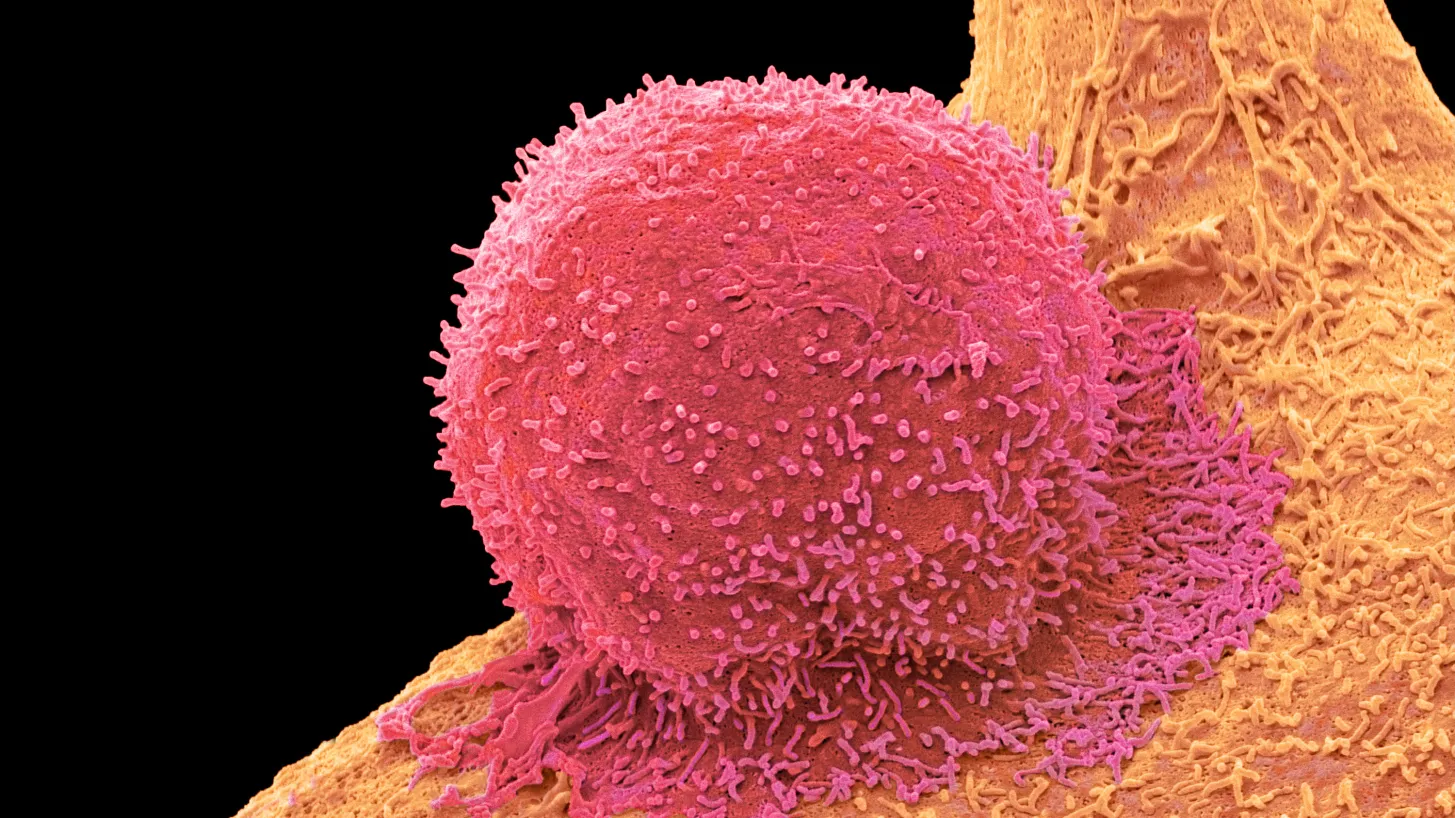
T세포(빨간색)와 유방암 세포의 컬러 주사전자현미경(SEM) 사진.
STEVE GSCHMEISSNER/SCIENCE PHOTO LIBRARY
Innovative new cell therapies could finally get at tough-to-target cancers
혁신적인 세포 치료법, 표적화 힘든 암 치료 길 열어주나
연구원들이 면역 세포를 조작해 고형 종양에 대한 표적화 능력을 높이고 있다.
지난 몇 년 사이 환자 자신의 면역 체계를 활용해 암세포를 파괴하는 조작된 T세포 기반의 치료법을 통해 치료가 어려웠던 일부 혈액암 치료 효과가 극적으로 향상됐다. 하지만 최근까지 연구원들은 암 진단 사례 중 가장 큰 비중을 차지하는 ‘고형 종양에 대한 T세포 치료법(이하 CAR T)’의 개발에는 큰 진전을 보이지 못했다.
이처럼 치료법 개발이 답보 상태에 빠지자 의료계는 큰 실망에 빠졌다. 매사추세츠 종합병원 암센터의 세포면역요법 책임자인 마르셀라 마우스(Marcela Maus)는 “얼마 전까지만 해도 CAR T가 모든 고형 종양 환자를 치료하지 못한다는 사실로 인해 약간 비관적인 분위기도 형성되었던 것 같다”고 말했다.