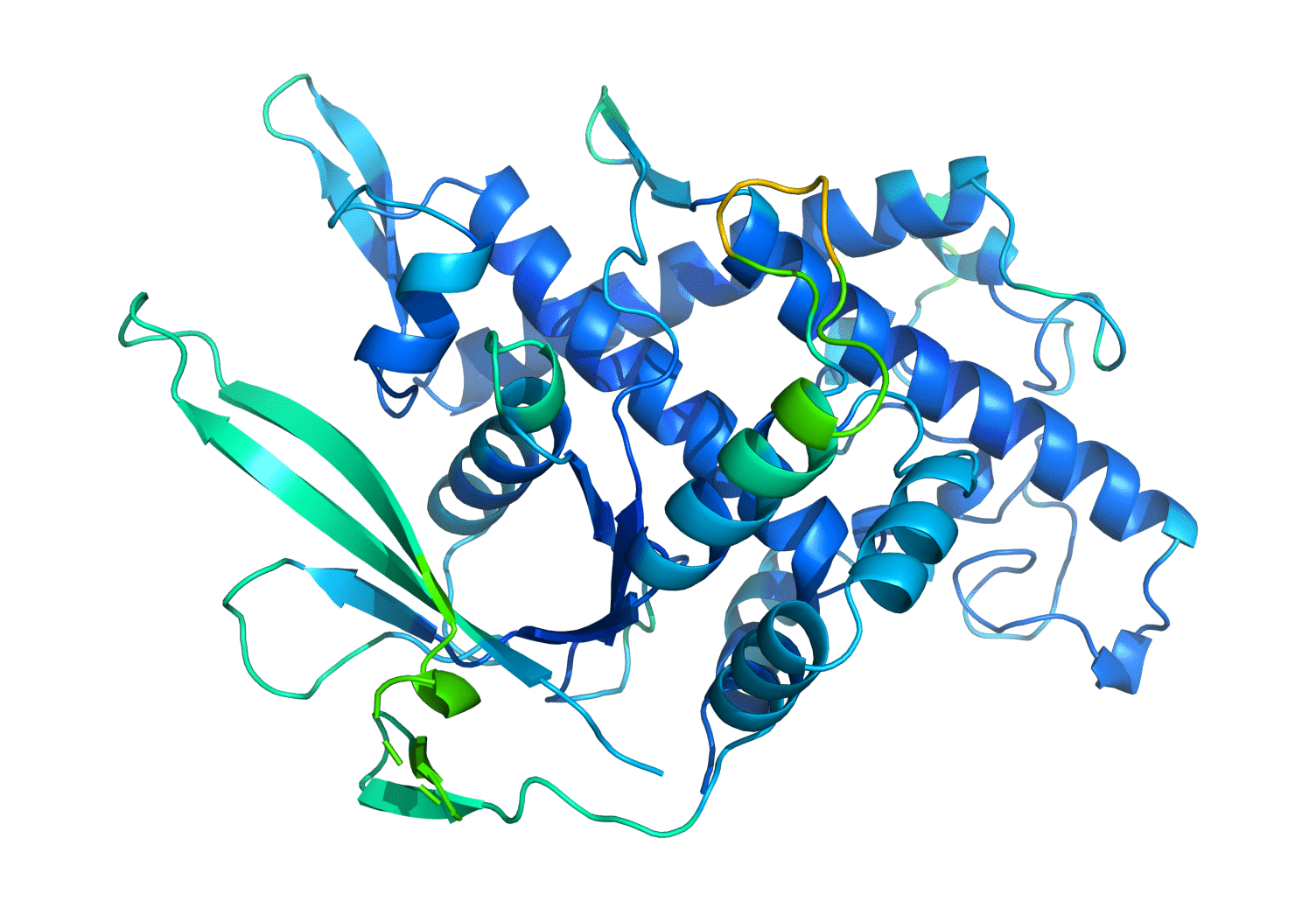
알파폴드가 생성한 모델이 단백질을 구성하는 아미노산의 접힌 구조를 보여준다.
사진제공: COURTESY OF DEEPMIND
This is the reason Demis Hassabis started DeepMind
데미스 허사비스가 딥마인드를 설립한 이유
몇 년 전 ‘알파고’로 세상에 강렬한 인상을 남겼던 딥마인드가 지난해에는 ‘알파폴드2’를 출시하며 과학계를 깜짝 놀라게 했다. 딥마인드의 다음 목표는 무엇일까? 딥마인드의 CEO 데미스 허사비스는 무엇을 꿈꾸고 있을까?
2016년 3월 알파벳의 자회사 딥마인드(DeepMind)의 최고경영자이자 공동설립자인 데미스 허사비스(Demis Hassabis)가 서울을 찾았다. 딥마인드가 개발한 바둑 인공지능(AI) ‘알파고(AlphaGo)’가 새로운 역사를 쓰는 장면을 보기 위해서였다. 알파고는 당시 국제대회 우승 횟수가 두 번째로 많았던 한국 최고의 바둑기사 이세돌과 다섯 경기를 하기로 예정되어 있었다. 세계에서 가장 복잡한 보드게임으로 여겨지며, 제대로 배우려면 몇 년씩 걸리는 바둑에 AI가 도전장을 내밀었다는 소식에 많은 이들이 주목했다.

이세돌은 자신이 알파고를 ‘압도적인 차이’로 이길 것이라고 예측했다. 그러나 실제로는 알파고가 4승 1패를 기록하며 압승을 거뒀다. 알파고의 승리는 바둑 전문가들뿐만 아니라 AI 전문가들에 이르기까지 모두에게 충격을 주었고, AI의 능력에 대한 세상의 인식을 바꾸어 놓았다.
그러나 딥마인드 개발팀이 알파고의 승리를 축하하고 있을 때 허사비스는 이미 더 큰 도전을 염두에 두고 있었다. 그는 알파고 개발을 이끌었던 데이비드 실버(David Silver)에게 “‘이제 때가 됐다’고 말했다”며 당시를 회상했다.
알파고의 대국을 지켜보면서 허사비스는 딥마인드의 기술력이 생물학계에서 가장 중요하고 복잡한 문제를 해결할 수준에 도달했다는 것을 깨달았다. 그 중요하고 복잡한 문제란 생물학자들이 지난 50년 동안 해결하기 위해 분투해왔던 ‘단백질 구조를 예측하는 일’이었다.









